| Переглянути всі підручники | |||||||||||||
| << | < | 35 | 36 | 37 | 38 | 39 | 40 | 41 | 42 | 43 | 44 | > | >> |
дістали назву ізопроцесів (від грецького «ізос» — рівний, однаковий). Рівняння стану газу для них легко дістати з рівняння Клапейрона, вважаючи один з параметрів сталою величиною. Розглянемо ізо-процеси, які відбуваються за сталої температури і називаються ізотермічними.
Ізотермічний процес. Якщо в рівнянні стану (10.3) вважати Т = const, права частина рівняння буде величиною сталою:
pV = const. (11.1)
Ця формула виражає закон, встановлений дослідним шляхом у середині XIX ст. англійським ученим Р. Бойлем і французьким фізиком Е. Маріоттом. Закон Бойля—Маріотта, або рівняння стану ідеального газу при ізотермічному процесі, означає: добуток тиску даної маси газу на об'єм, що його займає газ за сталої температури, є величиною сталою.
Закон Бойля—Маріотта можна перевірити експериментально за допомогою описаного вище приладу (див. мал. 17). Повільно змінюючи об'єм повітря в циліндрі за незмінної температури, спостерігають за показаннями манометра і переконуються, що зі зменшенням або збільшенням об'єму тиск відповідно зростає або зменшується у стільки ж разів.
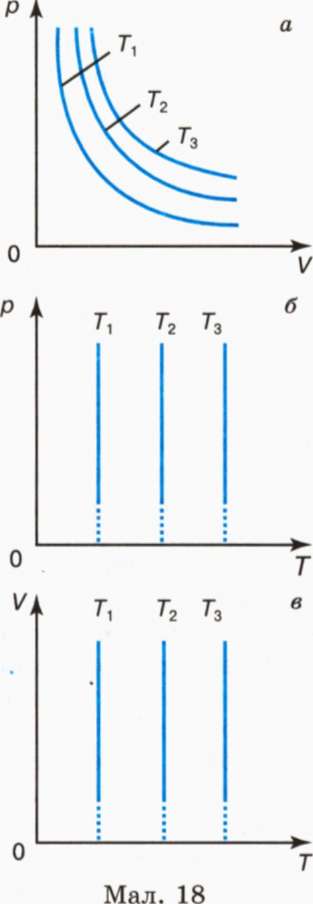
Графічно залежність між тиском і об'ємом газу за сталої температури зображають добре відомою з курсу математики гіперболою. Кожному значенню температури відповідає своя крива (мал. 18, а). Ці криві називають ізотермами (кривими однакових температур). Чим вища температура, за якої відбувається процес, тим вище розташована ізотерма ( T1<Т2< Т3).
У системах координат р, Т (мал. 18, б) і V, Т (мал. 18, в) ізотермічний процес зображається прямою, паралельною відповідно осі р або V. Ці прямі є також ізотермами. Третій параметр (V або р) не зберігає вздовж них сталого значення.
Ізобарний процес. Нехай тепер газ знаходиться в умовах,
| Переглянути всі підручники | |||||||||||||
| << | < | 35 | 36 | 37 | 38 | 39 | 40 | 41 | 42 | 43 | 44 | > | >> |