| Переглянути всі підручники | |||||||||||||
| << | < | 86 | 87 | 88 | 89 | 90 | 91 | 92 | 93 | 94 | 95 | > | >> |
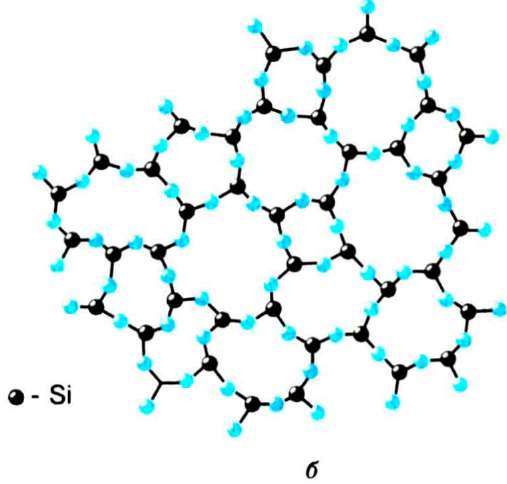
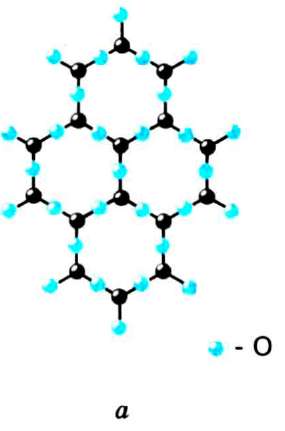
Мал. 60
властивості аморфних речовин пояснюються особливостями їх молекулярної будови, завдяки яким їх можна віднести швидше до рідин, ніж до твердих тіл.
Атоми або молекули аморфних тіл, як і молекули рідини, мають певний час «осілого життя» — час коливань біля положення рівноваги. Проте на відміну від рідин цей час у них досить великий. У цьому відношенні аморфні тіла наближаються до кристалічних, оскільки переходи атомів з одного положення рівноваги в інше відбуваються рідко.
У аморфних тіл на відміну від кристалів немає точного порядку в розміщенні атомів. Тільки найближчі атоми — сусіди — розміщуються за деяким порядком. Проте точного повторення в усіх напрямах того самого елемента структури (елементарної комірки), характерного для кристалів, в аморфних тіл немає.
Часто одна й та сама речовина може перебувати і в кристалічному, і в аморфному станах. Наприклад, кварц (Si02) може бути в кристалічній і в аморфній формі (кремнезем). Кристалічну форму кварцу схематично зображають у вигляді решітки з правильних шестикутників (мал. 60, а). Аморфна структура кварцу також має вигляд решітки, але неправильної. Крім шестикутників, у ній бувають п'яти- і семикутники (мал. 60, б).
Таким чином, за своєю внутрішньою будовою аморфні тіла близькі до рідин, відрізняючись від них лише меншими середніми відстанями між молекулами і в зв'язку з цим більшими силами молекулярного притягання. Тому аморфні тіла можна вважати переохолодженими рідинами.
| Переглянути всі підручники | |||||||||||||
| << | < | 86 | 87 | 88 | 89 | 90 | 91 | 92 | 93 | 94 | 95 | > | >> |