| Переглянути всі підручники | |||||||||||||
| << | < | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | > | >> |
Італійський фізик і хімік. Основні праці присвячені молекулярній фізиці. У 1811 р. відкрив важливий для фізики і хімії закон, згідно з яким у рівних об'ємах різних газів за однакових умов міститься однакова кількість молекул (закон Авогадро). Виходячи з цього закону, запропонував метод визначення атомних мас елементів і молекулярних мас речовин.
Число молекул в 1 моль дістало назву стала (або число) Авогадро на честь італійського вченого Амедео Авогадро. Позначається стала Авогадро NA; NA = 6,02- 1023 моль -1.
Як бачимо, будь-яка речовина, маса якої в кілограмах дорівнює відносній молекулярній масі Мr, містить 6,02 • 1026 молекул. Тому маса 1 моль речовини дорівнюватиме 0,001 МГ кг або Мr г.
Масу 1 моль речовини називають молярною масою і позначають М. Одиницею молярної маси служить 1 кг/моль. З розглянутого вище прикладу випливає, що числове значення молярної маси речовини, виражене в грамах, дорівнює відносній молекулярній масі цієї речовини. Якщо ж молярну масу виражати в кілограмах, то числове значення молярної маси буде в 1000 раз меншим: M = 10-3 Мг. Наприклад, молярна маса водню дорівнює 2-10-3 кг/моль, азоту — 28 -10 -3 кг/моль, вуглекислого газу — 44-10 -3 кг/моль.
Приклад. Чому дорівнює молярна маса цукру, формула якого С12Н22О11?
За ПС знаходимо відносні атомні маси Карбону (12), Гідрогену (1) і Оксигену (16). Відносна молекулярна маса цукру
Mr = 12-12 + 1-22 + 16-11 = 342.
Тоді молярна маса цукру дорівнює: M = 10-3 -342 кг/моль = = 0,342 кг/моль. Очевидно, що число молів v в даному тілі дорівнює

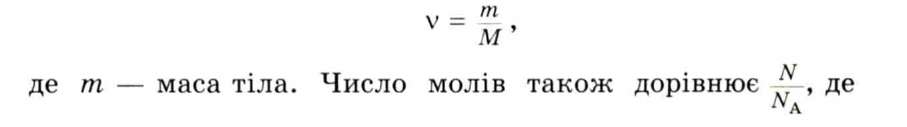
| Переглянути всі підручники | |||||||||||||
| << | < | 16 | 17 | 18 | 19 | 20 | 21 | 22 | 23 | 24 | 25 | > | >> |